Oghje ghjornu, a steatoepatite epatica non alcolica (NAFLD) hè diventata a causa principale di malatie croniche di u fegatu in Cina è ancu in u mondu. U spettru di a malatia include a steatoepatite epatica simplice, a steatoepatite non alcolica (NASH) è a cirrosi è u cancru di u fegatu correlati. A NASH hè carattarizata da un accumulu eccessivu di grassu in l'epatociti è da danni cellulari è infiammazione indotti, cù o senza fibrosi epatica. A gravità di a fibrosi epatica in i pazienti NASH hè strettamente assuciata à una prognosi epatica sfavorevole (cirrosi è e so cumplicazioni è carcinoma epatocellulare), eventi cardiovascolari, malignità extraepatiche è morte per tutte e cause. A NASH pò influenzà negativamente a qualità di vita di i pazienti; tuttavia, nisun medicamentu o terapia hè stata appruvata per trattà a NASH.
Un studiu recente (ENLIVEN) publicatu in u New England Journal of Medicine (NEJM) hà dimustratu chì a pegozafermina hà migliuratu sia a fibrosi epatica sia l'inflammazione epatica in i pazienti cun NASH non cirrotica cunfirmata da biopsia.
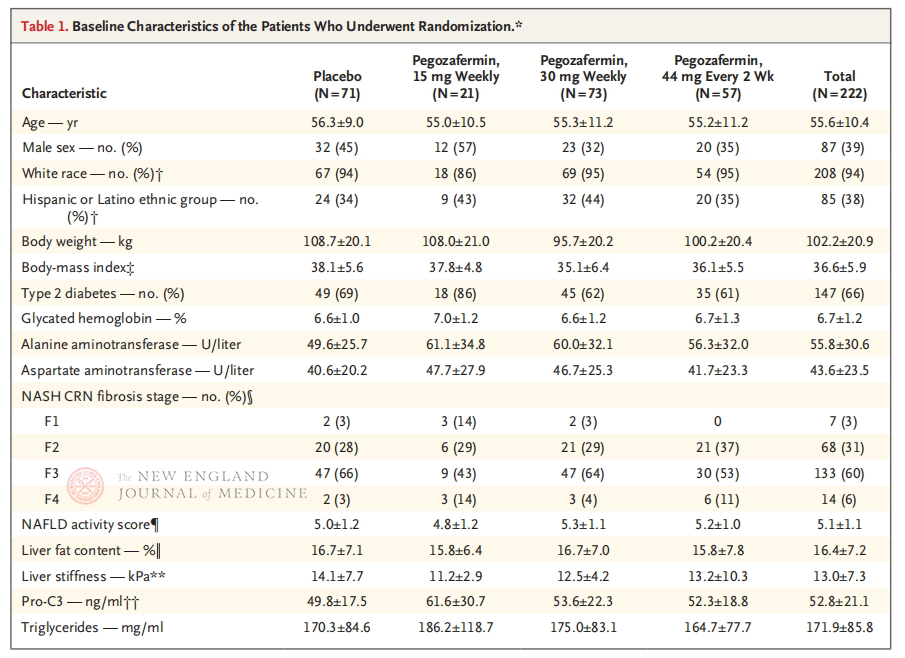
U studiu clinicu di Fase 2b multicentricu, aleatoriu, in doppio cieco, cuntrullatu da placebo, realizatu da u prufessore Rohit Loomba è a so squadra clinica à l'Università di California, San Diego School of Medicine, hà reclutatu 222 pazienti cun NASH di stadiu F2-3 cunfirmatu da biopsia trà u 28 di settembre di u 2021 è u 15 d'aostu di u 2022. Sò stati assignati à casu à pegozafermin (iniezione sottocutanea, 15 mg o 30 mg una volta à settimana, o 44 mg una volta ogni 2 settimane) o placebo (una volta à settimana o una volta ogni 2 settimane). L'endpoint primari includenu un miglioramentu di a fibrosi ≥ di stadiu 1 è nisuna progressione di a NASH. A NASH si hè risolta senza progressione fibrotica. U studiu hà ancu realizatu una valutazione di a sicurezza.
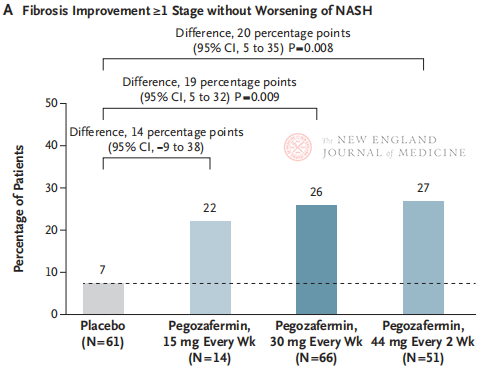
Dopu à 24 settimane di trattamentu, a proporzione di pazienti cun miglioramentu di u stadiu ≥ 1 in a fibrosi è senza peghjuramentu di a NASH, è a proporzione di pazienti cun regressione di a NASH è senza peghjuramentu di a fibrosi eranu significativamente più alte in i trè gruppi di dosi di Pegozafermin chè in u gruppu placebo, cù differenze più significative in i pazienti trattati cù 44 mg una volta ogni duie settimane o 30 mg una volta ogni settimana. In termini di sicurezza, a pegozafermin era simile à u placebo. L'effetti avversi più cumuni assuciati à u trattamentu cù pegozafermin eranu nausea, diarrea è eritema à u situ di iniezione. In questu studiu di fase 2b, i risultati preliminari suggerenu chì u trattamentu cù pegozafermin migliora a fibrosi epatica.
A pegozafermina, aduprata in questu studiu, hè un analogu glicolatu à longa durata d'azione di u fattore di crescita di i fibroblasti umani 21 (FGF21). FGF21 hè un ormone metabolicu endogenu secretu da u fegatu, chì ghjoca un rolu in a regulazione di u metabolismu di i lipidi è di u glucosiu. Studi precedenti anu dimustratu chì FGF21 hà effetti terapeutichi nantu à i pazienti NASH aumentendu a sensibilità à l'insulina di u fegatu, stimulendu l'ossidazione di l'acidi grassi è inibendu a lipogenesi. Tuttavia, a corta emivita di FGF21 naturale (circa 2 ore) limita u so usu in u trattamentu clinicu di NASH. A pegozafermina utilizza a tecnulugia di pegilazione glicosilata per allargà l'emivita di FGF21 naturale è ottimizà a so attività biologica.
In più di i risultati pusitivi di questu studiu clinicu di Fase 2b, un altru studiu recente publicatu in Nature Medicine (ENTRIGUE) hà dimustratu chì a pegozafermina hà ancu riduttu significativamente i trigliceridi, u colesterolu non HDL, l'apolipoproteina B è a steatosi epatica in i pazienti cun ipertrigliceridemia severa, ciò chì pò avè un impattu pusitivu nantu à a riduzione di u risicu di eventi cardiovasculari in i pazienti cun NASH.
Questi studii suggerenu chì a pegozafermina, cum'è ormone metabolicu endogenu, pò furnisce parechji benefici metabolichi à i pazienti cun NASH, in particulare perchè a NASH puderia esse rinominata steatosi epatica metabolicamente assuciata in u futuru. Questi risultati ne facenu una droga potenziale assai impurtante per u trattamentu di a NASH. À u listessu tempu, questi risultati pusitivi di u studiu susteneranu a pegozafermina in studii clinichi di fase 3.
Ancu s'è u trattamentu cù pegozafermin di 44 mg bisettimanale o di 30 mg settimanale hà righjuntu u puntu finale primariu istologicu di a prova, a durata di u trattamentu in questu studiu hè stata solu di 24 settimane, è u tassu di conformità in u gruppu placebo hè statu solu di 7%, chì era significativamente più bassu chè i risultati di studii clinichi precedenti di 48 settimane. E differenze è a sicurezza sò listesse? Data l'eterogeneità di a NASH, sò necessarii in u futuru studii clinichi internaziunali più grandi, multicentrici, per include pupulazioni di pazienti più grande è allargà a durata di u trattamentu per valutà megliu l'efficacia è a sicurezza di u medicamentu.
Data di publicazione: 16 di settembre di u 2023